

Organ
der
GD — Gesellschaft für Dermopharmazie e.V.
| Home |
| Ausgabe: 1/2016 |
| 1/2015 |
| 1/2014 |
| 1/2013 |
| 1/2012 |
| 2/2011 |
| 1/2011 |
| 1/2010 |
| 1/2009 |
| 1/2008 |
| 2/2007 |
| 1/2007 |
| 2/2006 |
| 1/2006 |
| 2/2005 |
| 1/2005 |
| 2/2004 |
| 1/2004 |
| 2/2003 |
| 1/2003 |
| 2/2002 |
| 1/2002 |
| 4/2001 |
| 3/2001 |
| 2/2001 |
| 1/2001 |
| 1/2000 |
| Weitere Links: |
| Gesellschaft für Dermopharmazie |
 |
Ausgabe 1 (2002) |
Dermotherapie
Transformierender
Wachstumsfaktor β (TGF-β)
Der Transformierende Wachstumsfaktor (TGF-β) gehört zu einer Familie von 40 strukturell ähnlichen Polypeptidwachstumsfaktoren, die eine faszinierende Vielfalt zellulärer Prozesse wie Apoptose, Proliferation sowie Differenzierung, Adhäsion und Beweglichkeit regulieren. Die Aufklärung der Signalkaskaden von TGF-β sowie die Kenntnis seiner physiologischen Bedeutung eröffnen Perspektiven für die Entwicklung neuer spezifischer Arzneistoffe. Für TGF-β beziehungsweise TGF-Agonisten erscheint ein Einsatz bei hyperproliferativen Hautkrankheiten wie Psoriasis vulgaris sinnvoll, während TGF-Antagonisten als Mittel zur Förderung der Wundheilung in Betracht kommen.

Bei Psoriasis vulgaris, der häufigsten hyperproliferierenden Hautkrankheit, kommt es neben einer verstärkten Teilungsrate und einer gestörten Differenzierung der Keratinozyten auch zur leukozytären Infiltration der Epidermis. Da TGF-β das Wachstum epidermaler Zellen inhibiert und deren Differenzierung fördert, scheint eine Störung in den Signalkaskaden von TGF-β an psoriatischen Prozessen beteiligt zu sein. Allerdings sind die intrazellulären Signalwege der Substanz in Keratinozyten bislang erst wenig erforscht. Im Folgenden sollen deshalb die bislang bekannten Fakten vorgestellt werden.
Die TGF-β-Familie umfasst neben der TGF-β- auch die Activin- und die BMP (Bone Morphogenetic Protein)-Unterfamilie. Diese Unterfamilien sind eng verwandt und kommen in nahezu allen zoologischen Spezies vor. Der Prototyp TGF-β kam zu seiner Bezeichnung, weil er als Faktor entdeckt wurde, der in Fibroblasten von Nagern einen transformierten Phänotyp erzeugte.
Signalwege von TGF-β
TGF-β ist unter dermatologischen Gesichtspunkten besonders interessant. Es ist erwiesen, dass es nicht nur antiproliferativ und differenzierend auf epidermale und hämatopoietische Zellen wirkt, sondern auch die Wundheilung sowie die Embryo- und die Angiogenese fördert. Außerdem erhöht TGF-β die immunologischen Eigenschaften von neutrophilen Granulozyten und Monozyten.
Sämtliche Effekte werden über membranständige Glycoproteinrezeptoren (Typ 1 und 2) vermittelt, die beide über Serin/Threonin-Kinase-Aktivität verfügen und spezifisch für die verschiedenen Mitglieder der TGF-β-Familie sind. Es kommt nur zu einer Auslösung von Folgeprozessen, wenn beide Rezeptoren sich durch die Überbrückung mit TGF-β zu einem Komplex zusammenlagern. Hierbei bindet TGF-β zunächst an den Typ-2-Rezeptor und ermöglicht damit die Annäherung des Typ-1-Rezeptors. Erst nach der Zusammenlagerung der Rezeptoren wird die Kinaseaktivität des Typ-1-Rezeptors „angeschaltet“, und sogenannte Smad-Proteine können sich daran anlagern, um durch ihn phosphoryliert zu werden. Sie sind es, die TGF-β-vermittelte Signale letztlich bis in den Zellkern an ihr Ziel, die „TGF-β-Gene“, übertragen (Abbildung 2, Seite16).
| Unter der Überschrift „Dermatotherapeutika am Horizont“ stellen wir Ihnen in loser Folge das pharmakologische Profil von Substanzen vor, die eines Tages Einzug in die Dermatotherapie halten könnten. Redaktionell betreut wird die Serie von Apothekerin Bettina Sauer, die als Doktorandin von Professor Dr. Monika Schäfer-Korting am Fachbereich Pharmazie der Freien Universität Berlin tätig ist. Nach der Besprechung des Makrolids Sirolimus und des monoklonalen Antikörpers Infliximab in DermoTopics Nr.1 beziehungsweise Nr. 3 (2001) geht es in dieser Ausgabe um die Perspektiven des Polypeptidwachstumsfaktors TGF-β beziehungsweise von dessen Agonisten und Antagonisten. TGF-Agonisten kommen für die Behandlung hyperproliferativer Hauterkrankungen wie Psoriasis vulgaris in Betracht, während TGF-Antagonisten als Mittel zur Förderung der Wundheilung Bedeutung erlangen könnten. |
Smad-Proteine und ihre Signalwege
Der Name der Smad-Proteine leitet sich von den sie kodierenden Genen ab, die in genetischen Studien an Drosophila und C. elegans erstmals identifiziert wurden. Das Drosophila-Gen wird als Mad (Mother against decapentaplegic), das Gen in C. elegans als Sma (Small body size) bezeichnet. Die Kombination dieser beiden Bezeichnungen kreiert den Namen „Smad“. Strukturell und funktionell unterscheidet man drei Unterfamilien der Smad-Proteine (Abbildung 1), denen allen eine ähnliche, stark konservierte Grundsequenz zu eigen ist.
Die Rezeptor-Smad-Proteine (R-Smads, Smad 2 und 3) interagieren direkt mit dem durch die oben beschriebenen Mechanismen aktivierten Typ-1-Rezeptor. Erst nach Phosphorylierung können die R-Smads die zytoplasmatischen kooperativen Smad-Proteine (Co-Smads, Smad 4) binden, die letztendlich der Anlagerung des Smad-Komplexes an DNA-Promotoren und der Transkriptionsaktivierung dienen.
Die dritte Gruppe sind die inhibitorischen Smad-Proteine (I-Smads, Smad 6 und 7). Sie zeichnen sich durch markante Strukturvariationen im Vergleich zu den R- und den Co-Smads aus. Hierauf ist zurückzuführen, dass sie die TGF-vermittelte Signaltransduktion kompetitiv antagonisieren. Beide I-Smads werden in Folge eines großen Angebots an Wachstumsfaktoren vermehrt gebildet, dienen also der negativen Rückkopplung. Sie können sowohl mit den R-Smads um Rezeptorbindung konkurrieren als auch die Wechselwirkung von R-Smad und Co-Smad verhindern.
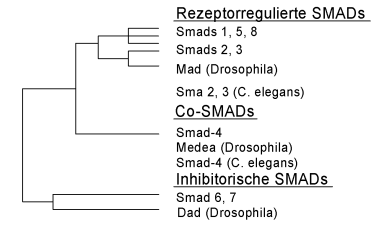 |
| Abbildung 1: Smad-Proteine und Interaktionen zwischen den Vertretern der drei Unterfamilien (Erläuterungen im Text) |
Aufbau der Smad-Proteine
Alle Smad-Proteine sind relativ ähnlich aufgebaut. Die hochkonservierten Kettenenden werden über einen Linker variabler Länge und Sequenz verknüpft. Der N-Terminus von Smad 4, die so genannte MH1-Domäne, erfüllt nach Aktivierung und Translokation in den Zellkern die Funktion der Bindung an DNA-Promotoren. Die C-terminale MH2-Domäne kann an diverse Proteine binden, zum Beispiel an die Typ-1-Rezeptoren, an andere Smads und an Transkriptionsfaktoren.
Der Smad-Komplex permeiert nach der Phosphorylierung in den Zellkern, wo er über die MH2-Domäne der R-Smads Wechselwirkungen mit Transkriptionsfaktoren eingeht oder durch die Anlagerung von der MH1-Domäne von Smad 4 an Promotoren direkt die Genexpression vermittelt. Als Beispiel für letzteres seien die Gene p15 und p21 genannt. Beide kodieren cyclinabhängige Kinaseinhibitoren, die den Zellzyklus anhalten und damit die Proliferation verlangsamen. Auch an den Promotoren der I-Smad-Gene finden sich Bindungsstellen für Smads, die der Hochregulierung der I-Smads dienen. Smad-Komplexe scheinen sich aber auch hemmend auf DNA-Segmente wachstumsfördernder Gene wie c-myc auszuwirken.
Für den Zusammenschluss von Smad-Proteinen mit Transkriptionsfaktoren sei der Activin Responsive Factor (ARF) angeführt. Dieser kann mit dem Activin Responsive Element (ARE) am Mix2-Gen erst nach Kooperation mit dem Smad-Komplex interagieren.
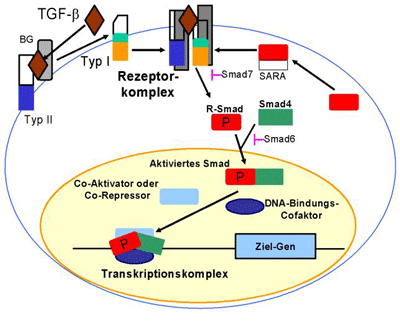 |
| Abbildung 2: Der zelluläre Signalweg von TGF-β ist sehr komplex: TGF-β bindet an seinen membranständigen Typ-2-Rezeptor und ermöglicht dadurch die Anlagerung des Typ-1-Rezeptors. Dann aktiviert TGF-β die Kinasefunktion des Typ-2-Rezeptors mit nachfolgender Stimulierung der Kinase-funktion des Typ-1-Rezeptors. Die so genannten Rezeptor-Smad-Proteine (Smad 2 und Smad 3) binden an den Rezeptorkomplex und werden durch den Typ-1-Rezeptor phosphoryliert. Das Smad-Ankerprotein SARA unterstützt die Anlagerung der R-Smads. Die phosphorylierten R-Smad-Proteine bilden einen Komplex mit dem kooperativen Smad 4. Dieser ist in der Lage, in den Zellkern einzudringen. Hier lagern sich die aktivierten R-Smads an DNA-Promotoren und/oder Transkriptionsfaktoren an und steuern Transkriptionsprozesse. Die inhibitorischen Smad-Proteine (Smad 6 und Smad 7) antagonisieren die Anlagerung der R-Smads an den Rezeptorkomplex oder an Smad 4 (weitere Erläuterungen im Text). |
Defekte der TGF-β- und Smad-Signalwege
Mit der zunehmenden Etablierung des Knock-out-Verfahrens und dessen Anwendung auch auf Smad-Proteine und TGF-β wurde es möglich, die Auswirkungen des Fehlens dieser Signalmoleküle auf die geordnete Hautentwicklung zu beobachten. Bei diesem Eingriff, der Gene für bestimmte Proteine gezielt ausschaltet, wird die Blastozyste, die sich nach der natürlichen Befruchtung ausbildet, entnommen und mit Fremd-DNA transfiziert. Die Einfuhr der DNA erfolgt durch Transfer per Retroviren oder Mikroinjektion. Anschließend werden die Embryonalzellen einer Leihmutter implantiert und in ihrer Entwicklung beobachtet. Die beigefügte DNA, die von selbst aus dem Zytoplasma in den Zellkern gelangt, enthält ein Segment, das dem auszuschaltenden Gen exakt entspricht. Dieses Segment lagert sich im Zuge der homologen Rekombination an die Zielsequenz an und verschmilzt mit dieser an der Überlagerungsstelle. Da hierbei auch die gesamte Trägerstruktur in das Gen eingebaut wird, sind die Transkription und die resultierende Proteinsynthese nicht mehr möglich.
Verschiedene Arbeitsgruppen haben Smad 2, 3 und 4 sowie TGF-β ausgeschaltet. Nur die Smad-3-Knock-out-Maus überlebt die Embryogenese. Fehlen Smad 2 oder Smad 4, unterbleibt die geordnete Ausbildung der Keimblätter. Die Smad-5-Knock-out-Maus stirbt am 10. Embryonaltag, da sie nicht in der Lage ist, ein Blutgefäßsystem auszubilden.
Bei der Ausschaltung von Sma d 3 zeigt sich direkt nach der Geburt eine immunologische Dysregulation in Form starker Abszess- und Fistelbildungen in den Mucosaschichten, der die Mäuse spätestens im Alter von drei Wochen erliegen. Vorher kommt es zur starken Hyperproliferation von Keratinozyten, die sich in Schuppen von der Haut ablösen. TGF-β kann an diesen Geweben seine antiproliferativen Effekte nicht mehr entfalten. Diese Ergebnisse stehen in Einklang mit der verminderten Expression von TGF-β-Rezeptoren bei Psoriasis und zeigen die Bedeutung von TGF-β und Smad 3 in der Behandlung von hyperproliferativen Erkrankungen.
Einfluss von TGF-β auf die Wundheilung
Da TGF-β ein wundheilungsförderndes Zytokin ist, verblüfft es, dass Smad-3-Knock-out-Mäuse nach Verletzungen eine deutlich beschleunigte Wundheilung aufweisen. Der Wundheilungsvorgang ist gekennzeichnet durch eine Ausschüttung von TGF-β aus degranulierenden Thrombozyten, die in das Wundareal einwandern. TGF-β bewirkt eine starke Migration von Monozyten und Neutrophilen in die Region. Diese eliminieren Mikroorganismen, halten die Wundränder sauber, fördern allerdings auch durch Zytokin- und Proteasefreisetzung lokale Entzündungen, die der Wundheilung nicht dienlich sind.
Auch Fibroblasten vollziehen TGF-β-stimuliert eine Chemotaxis, proliferieren stark, bewirken die Wundrandkontraktion zum besseren Verschluss und sezernieren Matrixmaterial wie Kollagen und Fibronectin zur Gewebsrekonstruktion. TGF-β aktiviert Smad-vermittelt die Transkription der Gene für Kollagen und Fibronectin. Die in den Wundbereich eingewanderten Leukozyten und Fibroblasten sezernieren erneut TGF-β. So steigt dessen Gewebsspiegel zunehmend an und verstärkt die Migration, bis eine kompensatorische Downregulation von Smad 3 eintritt. Jetzt erst sinkt die Aktivität der beschriebenen Zellen. Gleichzeitig sinken die TGF-β-Spiegel, und die Proliferationshemmung der Keratinozyten wird aufgehoben. So findet schließlich eine Re-Epithelisierung der Wunde statt.
Die beschleunigte Wundheilung bei Fehlen von TGF-β beziehungsweise Downregulation von Smad 3 kommt zum einen wahrscheinlich durch die verstärkte Keratinozytenproliferation zustande. Zum anderen verhindert die reduzierte Monozyteninfiltration, die sich bei fehlender Wundkontamination nicht negativ auswirkt, das Entstehen von Entzündungen. Diese beiden Faktoren scheinen die verminderte Matrixbildung mehr als zu kompensieren. Die Wunden von Smad-3-Knock-outs heilen innerhalb von zwei Tagen ab, während Wildtyp-Mäuse durchschnittlich vier bis fünf Tage für diesen Prozess benötigen. Doch die Bewertung dieses Faktums bleibt schwierig. Wenn bei Smad 3-Mangel die Matrixbildung unterrepräsentiert ist, kann das zu Lasten eines stabilen Neugewebes gehen. Außerdem sind die Abwehrmechanismen bei bakteriellen Kontaminationen ohne die Einwanderung von Immunzellen unzureichend.
Perspektiven für neue Arzneistoffe
Die Aufklärung der Signalkaskaden von TGF-β sowie die Kenntnis seiner physiologischen Bedeutung scheinen für die Entwicklung neuer spezifischer Arzneistoffe von Bedeutung zu sein. TGF-Agonisten könnten bei hyperproliferativen Hauterkrankungen wie Psoriasis, TGF-Antagonisten bei der Wundheilung einsetzbar sein. Obwohl TGF-β bislang in keiner Darreichungsform zur Verfügung steht, kommt seine Verwendung als Medikament durchaus in Betracht. Entsprechendes gilt für Wirkstoffe, die den TGF-β-Stoffwechsel modifizieren oder den TGF-β-Signalweg beeinflussen. Hierbei ist an Substanzen zu denken, die Rezeptoren stimulieren beziehungsweise inhibieren, oder an solche, die Smad-Proteine modulieren. Die Vielzahl von Eingriffsmöglichkeiten auf den verschiedenen Stufen der Signalkaskade von TGF-β eröffnet vielversprechende Perspektiven bei der Suche nach neuen Wirkstoffen.
Literatur
[1] Ashcroft GS, Yang X, Glick AB, Weinstein M, Letterio JL, Mizel DE, Anzano M, Greenwell-Wild T, Wahl SM, Deng C, Roberts AB: Mice lacking Smad3 show accelerated wound healing and an impaired local inflammatory response. Nat. Cell Biol. 1 (1999) 260-266
[2] Itoh S, Itoh F, Goumans MJ, Ten Dijke P: Signaling of transforming growth factor-beta family members through Smad proteins. Eur. J. Biochem. 267 (2000) 6954-6967
[3] Massague J: TGF-β signal transduction. Annu. Rev. Biochem. 67 (1998) 753-791
[4[ Yang X, Letterio JJ, Lechleider RJ, Chen L, Hayman R, Gu H, Roberts AB, Deng C: Targeted disruption of SMAD3 results in impaired mucosal immunity and diminished T cell responsiveness toTGF-β. Embo. J. 18 (1999) 1280-1291
nach oben