GD — Gesellschaft für Dermopharmazie e.V.
| Home |
| Ausgabe: 1/2016 |
| 1/2015 |
| 1/2014 |
| 1/2013 |
| 1/2012 |
| 2/2011 |
| 1/2011 |
| 1/2010 |
| 1/2009 |
| 1/2008 |
| 2/2007 |
| 1/2007 |
| 2/2006 |
| 1/2006 |
| 2/2005 |
| 1/2005 |
| 2/2004 |
| 1/2004 |
| 2/2003 |
| 1/2003 |
| 2/2002 |
| 1/2002 |
| 4/2001 |
| 3/2001 |
| 2/2001 |
| 1/2001 |
| 1/2000 |
| Weitere Links: |
| Gesellschaft für Dermopharmazie |
 |
Ausgabe 1 (2003) |
Autorenbeitrag
Horst Spielmann
Neue Methoden zur tierversuchsfreien Verträglichkeitsprüfung von Kosmetika
Manuskript in Anlehnung an den Vortrag am 2. April 2003 in Bonn auf der 7. Jahrestagung der GD Gesellschaft für Dermopharmazie
Zusammenfassung: In Deutschland und allen EU Mitgliedsstaaten wird die Verträglichkeitsprüfung von Kosmetika in Tierversuchen in der Öffentlichkeit stark kritisiert. Dieser Kritik, die von Tierschutzverbänden ausging, haben sich inzwischen die Verbraucher und die Behörden und Regierungen der EU Mitgliedsstaaten angeschlossen. Nach mehrjähriger Diskussion wurde die vom EU Parlament vorgeschlagene 7. Änderung der EU Kosmetikrichtlinie 76/768/EEC (EU Kommission 1976) am 27. Februar 2003 vom Ministerrat der EU Mitgliedsstaaten akzeptiert (EU Richtlinie 2003/15/EG), die eine stufenweise Einschränkung von Tierversuchen für Kosmetika und ein Verbot in 10 Jahren vorsieht. Grund für das abgestufte Vorgehen ist die Tatsache, dass noch nicht alle zur Prüfung von Kosmetika vorgeschriebenen Tierversuche durch tierversuchsfreie Methoden ersetzt werden können. Gleichzeitig wurden bei der Entwicklung, Validierung und internationalen behördlichen Anerkennung neuer, tierversuchsfreier Prüfmethoden in den letzten 10 Jahren erhebliche Fortschritte erzielt, so daß der Ersatz der Tierversuche bei der Verträglichkeitsprüfung von Kosmetika in naher Zukunft möglich sein wird. Es werden deshalb die Fortschritte vorgestellt, die aufgrund der gemeinsamen Anstrengungen von Wissenschaftlern in Laboratorien der Kosmetikindustrie und anderen Forschungsinstituten beim der Entwicklung von Alternativmethoden zu Tierversuchen erzielt wurden.
Rechtliche Rahmenbedingungen
in der EU für die sicherheitstoxikologische
Prüfung von Kosmetika
Bei der Umsetzung der EU Kosmetik Richtlinie 97/18/EG ist zu beachten, dass es einerseits Stoffe gibt, die ausschließlich nach den Vorgaben der EU-Kosmetik-Richtlinie sicherheitstoxikologisch zu prüfen sind, und dass es außerdem Stoffe gibt, die als Inhaltsstoffe in kosmetischen Produkten eingesetzt werden und toxikologisch als Industriechemikalien geprüft werden, da sie primär nicht in Kosmetika eingesetzt werden. Die zuletzt genannten Stoffe werden sehr umfangreich nach dem Chemikalienrecht unter Gesundheits- und Umweltschutz-Aspekten geprüft. Außerdem ist wichtig, dass kosmetische Fertigprodukte seit der Novellierung des Tierschutzgesetzes im Jahre 1987 in Deutschland nicht mehr im Tierversuch geprüft werden dürfen. Diese gesetzliche Vorgabe wird inzwischen aufgrund einer Selbstverpflichtung der Kosmetikindustrie seit dem Jahr 2000 in allen EU Mitgliedsstaaten eingehalten, weil bei der Entwicklung tierversuchsfreier Prüfmethoden erhebliche Fortschritte erzielt wurden und weil gleichzeitig bisher keine Nachteile für den Verbraucher bekannt wurden. Diese erfreuliche Entwicklung bestätigen sowohl der europäische Verband der Hersteller von Kosmetika COLIPA als auch das Expertengremium der EU-Komission für die gesundheitliche Bewertung von Kosmetika SSCNFP, das Scientific Committee on Cosmetic Products, and Non-Food Products. Es ist dabei bemerkenswert, dass der aus wissenschaftlicher, wirtschaftlicher und ethischer Sicht erfreuliche Fortschritt aufgrund einer freiwilligen Verpflichtung der Hersteller von Kosmetika erzielt wurde, ohne dass die EU Kosmetikrichtlinie bisher ein Vermarktungsverbot für kosmetische Fertigprodukte vorschreibt.
Rechtliche Rahmenbedingungen
für die Durchführung von
Tierversuchen in der EU
Nach der EU Richtlinie 86/609/EWG (EU 1986) zum Umgang mit Versuchstieren, die auch die gesetzliche Grundlage für das Deutsche Tierschutzgesetz bildet, darf nach § 7.2 "ein Tierversuch nicht durchgeführt werden, wenn eine wissenschaftlich fundierte tierversuchsfreie Methode zur Verfügung steht, die in der Praxis experimentell erprobt ist." Weiterhin heißt es in Artikel 23 derselben EU Richtlinie: "Die EU Kommission und die Mitgliedsstaaten sollen Forschung zur Entwicklung und Validierung von Alternativmethoden fördern, die die gleichen Informationen wie der Tierversuch liefern aber geringere Tierzahlen erfordern oder weniger belastend sind, und sie sollen die Rahmenbedingungen für diese Forschung stärken." Diese gesetzlichen Vorgaben wurden von verschiedenen EU Mitgliedsstaaten unterschiedlich umgesetzt. Beispielsweise hat Deutschland bereits 1989 im damaligen Bundesgesundheitsamt BGA die Zentralstelle zur Erfassung und Bewertung von Ersatz- und Ergänzungsmethoden zum Tierversuch ZEBET gegründet, während die meisten EU Mitgliedsstaaten - mit wenigen Ausnahmen - keine eigenen Förderprogramme für Alternativmethoden zu Tierversuchen initiiert haben und sich auf Aktivitäten der EU Kommission verlassen.
In Abbildung 1 sind die europäischen Zentren zur Förderung
von Alternativmethoden dargestellt. Aus der Abbildung wird deutlich, dass
danach in England in Nottingham die Stiftung FRAME (Fund for the Replacement
of Animals in Medicial Experiments) und in den Niederlanden das NCA
(National Centre for Alternatives) im Reichsgesundheitsamt (RIVM)
gegründet wurden und von der EU Kommission im Jahr 1992 das EU Valdierungszentrum
ECVAM (European Centre for the Validation of Alternative Methods)
in der Gemeinsamen Forschungsstelle (GFS) in Ispra/Italien. Wegen der
Erfolge der europäischen Zentren wurde außerhalb Europas im
Jahr 1995 von der Regierung der USA das Validierungszentrum ICCVAM (Interagency
Coordinating Committee for the Validation of Alternative Methods)
im Rahmen des National Toxicology Program NTP gegründet, und Polen
hat 2001 als zukünftiges Beitrittsland der EU das Zentrum für
Alternativmethoden "Vitryna" in Lodsz etabliert.
|
Abbildung 1 |
7. Änderung der EU Kosmetikrichtlinie
im Jahr 2003 verabschiedet
Die im Februar 2003 in Kraft getretene 7. Änderungsrichtlinie 2003/15/EG (EU 2003) zur EU Kosmetikrichtlinie von 1976 (EU 1976) soll in einzelnen Schritten zu einem Verbot der Vermarktung von Kosmetika führen, deren Inhaltsstoffe in Tierversuchen geprüft wurden. Dieses abgestuften Verfahren soll innerhalb von 10 Jahren zu einem Ersatz der Mehrzahl der bisher üblichen sicherheitstoxikologischen Tierversuche durch tierversuchsfreie "Alternativmethoden" führen, bei denen Zellen und Gewebekulturen sowie molekularbiologische und molekulargenetische Methoden eingesetzt werden. In der 7. Änderungsrichtlinie hat die EU Kommission ein sehr detailliertes zeitliches Vorgehen festgelegt.
1. Bereits 2003 müssen folgende tierversuchsfreien
Methoden angewendet werden:
Bei der Prüfung aller Fertigprodukte und bei Prüfung von Inhaltsstoffen
auf Penetration durch die Haut, auf ätzende und auf phototoxische
Eigenschaften.
2. Bis Ende 2006 soll auf folgende Tierversuche
verzichtet werden:
Die Prüfungen auf augenreizende, hautreizende und hautsensibilisierende
Eigenschaften.
3. Bis Ende 2012, also in 10 Jahren, soll auf folgende
Tierversuche verzichtet werden:
Die Prüfung auf embryotoxische Eigenschaften.
4. Auch im Jahre 2013 werden folgende komplexen
Tierversuche nach Einschätzung der EU Kommission für die Prüfung von
Kosmetika noch erforderlich sein:
Die Prüfungen auf fruchtbarkeitshemmende und auf krebserzeugende Eigenschaften
sowie die Bestimmung der Verteilung und des Metabolismus von Fremdstoffen
im Organismus (Toxikokinetik).
Grundsätzlich müssen unabhängig von dieser Terminsetzung in der 7. Änderungsrichtlinie der EU Kosmetikverordnung alle sicherheitstoxikologischen Alternativmethoden anstelle von Tierversuchen angewendet werden, wenn sie nach experimenteller Validierung von der EU als offizielle Prüfmethoden für chemische Stoffe in den Anhang V der EU Gefahrstoffverordnung (EU Richtlinie 67/548/EEC, EU 1967) aufgenommen wurden.
Ersatz sicherheitstoxikologischerTierversuche durch
tierversuchsfreie Methoden
Sicherheitstoxikologische Prüfungen sind für alle chemischen Stoffe
vorgeschrieben und zwar, aus Arbeitsschutzgründen, um Arbeiter zu schützen,
die bei der Herstellung mit ihnen in Berührung kommen. Weitere Prüfungen
sind zum Verbraucherschutz unter Berücksichtigung der Anwendung vorgeschrieben,
z.B. für Kosmetika, Nahrungsmittelzusatzstoffe und Arzneimittel. Außerdem
müssen seit wenigen Jahren Prüfungen zur Umweltverträglichkeit neuer Stoffe
durchgeführt werden. International hat es sich in der Toxikologie als
zweckmäßig erwiesen, in einem ersten Schritt die gefährlichen Eigenschaften
eines Stoffes in international standardisierten Tierversuchen zu bestimmen,
z.B. in Europa nach den Vorschriften der EU (EU Gefahrstoffverordnung,
EU Richtlinie 67/548/EEC) und weltweit nach den Prüfmethoden der OECD
(Organisation for Economic Cooperation and Development) (OECD 1982).
Die in der EU vorgeschriebenen toxikologischen Prüfmethoden werden im
Anhang V der Gefahrstoffverordnung publiziert. Sie sind zusammengefaßt
in Tabelle 1 wiedergegeben, dabei sind die Methoden besonders hervorgehoben,
mit denen die lokale Verträglichkeit der Inhaltsstoffe von Kosmetika geprüft
wird.
| Tabelle 1: | |
| Sicherheitstoxikologische Prüfmethoden der EU und OECD | |
| akute Versuche mit einmaliger Applikation | |
| • | akute Toxizität, dermal & oral |
| • | Augenreizung/-ätzung |
| • | Hautreizung/-ätzung |
| • | Sensibilisierung der Haut |
| • | Hautpenetration |
| II. | Langzeitversuche mit mehrfacher Applikation |
| subakute Toxizität | |
| subchronische Toxizität | |
| >chronische Toxizität | |
| III. | spezielle und organspezifische Toxikologie |
| Metabolismus & Toxikokinetik (ADME) | |
| Neurotoxizität & Immunotoxizität | |
| Teratogenität/Embryotoxizität | |
| Reproduktionstoxikologie | |
| • | Genotoxizität/Mutagenität |
| Karzinogenität | |
| • = Diese Prüfmethoden sind für die Verträglichkeitsprüfung von Inhaltsstoffen von Kosmetika unerläßlich | |
Wenn die In Tabelle 1 aufgeführten sicherheitstoxikologischen
Tierversuche entsprechend der 7. Änderung der EU Kosmetikrichtlinie 76/768/EEC
durch tierversuchsfreie Methoden ersetzt werden sollen, müssen die neuen
Methoden entsprechend den Empfehlungen der EU und der OECD (OECD 1996)
experimentell validiert werden, um nachzuweisen, dass die Ergebnisse,
die mit den neuen Methoden erzielt werden, in gleicher Weise eine Abschätzung
der gefährlichen Eigenschaften neuer Substanzen gestatten, wie die etablierten
Tierversuche. Das prinzipielle Vorgehen bei der experimentellen Validierung
toxikologischer Prüfmethoden in mehreren Laboratorien unter blinden Bedingungen
mit einer ausreichen großen Zahl von Prüfsubstanzen ist in Abbildung
2 schematisch wiedergegeben (OECD 1996). Es ist offensichtlich, dass
es relativ lange dauert und sehr teuer ist, bis eine neue Methode erfolgreich
die langen Weg der Validierung durchlaufen hat und auch international
von allen OECD Mitgliedsstaaten anerkannt wird, d.h. von allen wichtigen
Industrienationen. Bisher wurden von EU und OECD nach etwa 10-jähriger
experimenteller Validierung nur 4 tierversuchsfreie Alternativmethoden
in die offiziellen behördlichen Prüfrichtlinien aufgenommen, und zwar
Teste zur Prüfung auf ätzende und phototoxische Eigenschaften sowie auf
Penetration durch die Haut und auf sensibilisierende bzw. allergisierende
Wirkung an der Haut.
|
Abbildung
2 |
Die bisherigen Fortschritte bei der Entwicklung, Validierung und behördlichen Anerkennung tierversuchsfreier sicherheitstoxikologischer Prüfmethoden werden nachfolgend erläutert:
1. Augenreizung
Die einfache Forderung, den stark belastenden Draize-Test am Kaninchenauge zur Prüfung auf augenreizende Eigenschaften mit Hilfe einer oder mehrerer in vitro Methoden zu ersetzen, hat sich trotz aufwendiger Validierungsstudien nicht erfüllt. Ursache dafür ist, dass
1. der Draize-Tests
für unterschiedlichen Zwecken eingesetzt wird, und zwar zur Prüfung von
Stoffen auf
- Unbedenklichkeit bei Anwendung am Auge sowie
- auf geringe und
- auf stark augenreizende Eigenschaften
2. zum anderen werden im Draize-Test Reaktionen an verschiedenen Teilen des Organs Auge (Bindehaut, Hornhaut und Linse) bewertet und
3. außerdem werden bei internationaler Betrachtung die Reaktionen im Draize-Test von nationalen Behörden mit sehr unterschiedlichen Maßstäben bewertet.
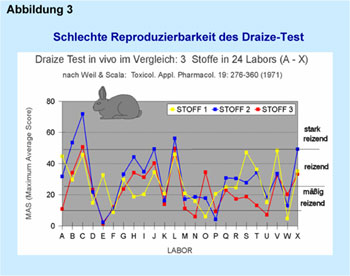
Ein grundsätzliches, bekanntes Problem ist beim Draize-Test am Kaninchenauge
außerdem die schlechte Reproduzierbarkeit, die bereits 1971 in den USA
von Weil und Scala in einer umfangreichen Validierungsstudie nachgewiesen
wurde und deren Ergebnis in Abbildung 3 dargestellt ist.
|
Abbildung
3 |
In Europa wurde eine große Zahl von Alternativmethoden zum Ersatz des
Draize-Test entwickelt und validiert. Bisher ist die Anwendung der neuen
Methoden nur zur Einstufung und Kennzeichnung von Stoffen mit stark augenreizenden
Eigenschaften gestattet. In Abbildung 4 sind die vier Alternativmethoden
zusammengestellt, die in unterschiedlichen EU Mitgliedsstaaten entwickelt
und validiert wurden. Prüfergebnisse, die mit den vier in vitro Tests
erzielt werden, werden von allen EU Mitgliedsstaaten anerkannt werden.
Nicht so positiv ist die Situation außerhalb Europas, obwohl die OECD
seit 1987 die Entwicklung von Alternativmethoden zum Draize-Test am Kaninchenauge
mit Nachdruck von ihren Mitgliedsstaaten fordert. Tierversuchsfreie in
vitro Tests zur Unterscheidung zwischen nicht und gering augenreizenden
Eigenschaften, wie sie für die Kosmetikindustrie wichtig sind, werden
bisher trotz intensiver experimenteller Validierung für behördliche Zwecke
noch nicht akzeptiert. Das berücksichtigt die 7. Änderung der EU Kosmetikrichtlinie.
|
Abbildung
4 |
2. Reizwirkung an der Haut
Die Ergebnisse im Draize Test an der Kaninchenhaut zur Prüfung auf hautreizende Eigenschaften sind nach Meinung der EU Experten der DG Gesundheit und Verbraucherschutz nur teilweise auf den Menschen übertragbar. ECVAM und die OECD favorisieren eine neue Prüfstrategie, in der in vitro Methoden, die sich in toxikologischen Laboratorien der Industrie bewährt haben, mit einer anschließender Verträglichkeitsprüfung an freiwilligen Probanden am Menschen kombiniert werden. Mehrere EU und OECD Mitgliedsstaaten, wie z.B. Deutschland und Österreich, lehnen aus ethischen Gründen die Prüfung am Menschen anstelle der Prüfung im Tierversuch grundsätzlich ab. Eine ECVAM Validierungsstudie mit künstlicher menschlicher Haut (Modell EpiDermTM), die 1999-2000 durchgeführt wurde, ergab aufgrund der nicht ausreichenden Reproduzierbarkeit der biologischen Schädigungsparameter leider nicht das erwünschte erfolgreiche Ergebnis. Im Jahr 2003 hat ECVAM zusammen mit dem US Validierungszentrum ICCVAM eine internationale Validierungsstudie mit kommerziellen menschlichen Hautmodellen begonnen. Vom Ergebnis dieser Studie, an der alle wichtigen Hersteller von Kosmetika beteiligt sind, wird es abhängen, ob Ende 2006 auf Tierversuche zur Prüfung auf hautreizende Eigenschaften verzichtet werden kann, ohne den Verbraucherschutz zu gefährden, wie es in der 7. Änderung der EU Kosmetikrichtlinie vorgesehen ist.
3. Ätzwirkung an Haut und Schleimhäuten
ECVAM hat 1998 erfolgreich eine Validierungsstudie mit drei in vitro Methoden zur Prüfung auf Ätzwirkung an der Haut abgeschlossen, und zwar mit Rattenhaut und künstlicher menschlicher Haut (EpiskinTM & EpiDermTM), dabei handelt es sich um biotechnologisch hergestellte, kommerzielle vertriebene menschliche Hautmodelle. Im Jahr 2000 wurden diese validierten Methoden von der EU Kommission als offizielle Prüfmethoden in den Anhang V der Gefahrstoffverordnung (EU Richtlinie 67/548/EEC) aufgenommen (EU Kommission, 2000a). Sie müssen deshalb nach EU Richtlinie 86/609/EWG zum Schutz von Versuchstieren angewendet werden und in den EU Mitgliedsstaaten sind Tierversuche zu diesem Zweck verboten. Besonders erfreulich ist, dass im Jahr 2002 die Expertenkommission der OECD eine spezielle Methode zur Prüfung auf Ätzwirkung mit menschlichen Hautmodellen für die weltweite Anwendung akzeptiert hat (OECD 2002a). Die erfolgreiche Entwicklung und Validierung dieser in vitro Methode mit dem Hautmodell EpiDerm™ wurde vom deutschen Validierungszentrum ZEBET koordiniert.
4. Sensibilisierung an der Haut
Sensibilisierende bzw. allergisierende Wirkungen sind die häufigste unerwünschte Eigenschaft chemischer Stoffe (10%). Bei Stoffen, die in Kosmetika eingesetzt werden sollen, sind sensibilisierende Eigenschaften nicht akzeptabel. Deshalb ist die Prüfung auf sensibilisierende Eigenschaften bei der sicherheitstoxikologischen Prüfung von Kosmetika unerläßlich. Der bisher übliche Sensibilisierungstest an der Haut von Meerschweinchen nach Magnusson und Kligman ist stark belastend weil Adjuvantien zur Reaktionsverstärkung in die Haut gespritzt werden und weil die immunologische Reaktion an der geschädigten Haut des Meerschweinchens geprüft wird. Seit 2001 akzeptieren die EU Mitgliedsstaaten, die USA und alle OECD Mitgliedsstaaten den sehr viel weniger belastenden LLNA (local lymphnode assay), der an den Ohr-Lymphknoten von Mäusen durch geführt wird, deren Wachstumshemmung in der in vitro Kultur geprüft wird (OECD 2002b). Der LLNA ist zwar kein reiner in vitro Test sondern ein „ex vivo Test“, bei dem die Belastung für die Versuchstiere stark reduziert ist.
5. Penetration durch die Haut
Bei Stoffen, die in Kosmetika oder als Pflanzenschutzmittel eingesetzt werden sollen, ist für die sicherheitstoxikologische Bewertung die Aufnahme durch die Haut entscheidend für die Wirkung im gesamten Körper. Die EU Expertenkommission für Kosmetika, das SCCNFP, hat grundsätzlich entschieden, daß Inhaltsstoffe von Kosmetika toxikologisch nicht auf systemische Wirkungen geprüft werden müssen, wenn sie nicht durch die Haut aufgenommen werden. Deshalb hat die Prüfung auf Hautpenetration eine entscheidende Bedeutung bei der Verträglichkeitsprüfung von Kosmetika. Im Juni 2001 hat die OECD die Prüfung auf Hautpenetration mit menschlicher Haut, die aus Operations-Material stammt, als einen der ersten weltweit gültigen in vitro Toxizitätstest zur Anerkennung empfohlen (OECD 2002c).
5. Phototoxizität
Seit 1992 hat ZEBET eine EU/COLIPA Prävalidierungs- und Validierungsstudie
von in vitro Phototoxizitätstests koordiniert, die 1998 mit der experimentellen
Validierung des 3T3 NRU in vitro Phototoxizitätstests (3T3 NRU PT Test)
erfolgreich abgeschlossen wurde, bei dem eine Fibroblastenzellinie der
Maus eingesetzt wird. Abbildung 5 veranschaulicht ein typisches
Beispiel für einen phototoxischen Stoff im 3T3 NRU in vitro Phototoxizitätstest.
Die Ergebnisse der Validierungsstudie mit 30 Prüfsubstanzen unter blinden
Bedingungen in 10 Laboratorien in Europa und den USA sowie eine zusätzlich
Validierungsstudie mit 10 UV-Filterstoffen, die in Sonnenschutzmitteln
eingesetzt werden, bestätigten, dass die Ergebnisse im 3T3 Test eine bessere
Prädiktion der phototoxischen Eigenschaften für den Menschen ermöglichen
als sie mit jeder anderen in vivo oder in vitro Prüfmethode erzielt wird
(Spielmann et al., 1998 a,b). Im Jahr 2000 hat deshalb die EU Kommission
den 3T3 NRU PT Test als einzigen Phototoxizitätstest in den Anhang V der
Gefahrstoffverordnung aufgenommen (EU Kommission, 2001c), so daß nur noch
dieser in vitro Test für behördliche Zwecke in Europa eingesetzt werden
darf und daß außerdem Tierversuch für diesen Zweck verboten sind. Im Jahr
2002 hat darüber hinaus eine Expertenkommission der OECD den 3T3 NRU PT
als offizielle weltweite Prüfmethode zur Phototoxizitätsprüfung akzeptiert
(OECD, 2002d). Damit ist der 3T3 NRU PT Test der erste in vitro Toxizitätstest,
der nach erfolgreicher experimenteller Validierung weltweit für behördliche
Zwecke akzeptiert wird. Abbildung
5
Beispiel für einen phototoxischen Stoff (Ketoprofen), der
im 3T3 NRU PT in vitro Phototoxizitätstest zu einem positiven
Ergebnis führt. Der Test wird in einer Mikrotiterplatte mit
96 Reaktionsgefäßen durchgeführt. UV-Bestrahlung
führt bei der phototoxischen Substanz in der unteren Platte
zu einer phototoxischen Reaktion, die dosisabhängig zur Entfärbung
führt.
Tierschutz und die Entwicklung
neuer Kosmetika sind miteinander vereinbar
Der wissenschaftliche Beirat des EU Validierungszentrums ECVAM hat im Jahr 2001 im Zusammenhang mit dem Vorschlag der EU Kommission für eine neue Chemikalienpolitik abgeschätzt, dass für toxikologischen Prüfmethoden in ca. fünf Jahren validierte, tierversuchsfreie Alternativmethoden zur Verfügung stehen werden. Die in Abbildung 6 zusammengefaßte Bewertung macht deutlich, dass für die wichtigsten Gebiete der Toxikologie sehr bald tierversuchsfreie Methoden zur Verfügung stehen werden (EU Kommission 2001).
|
Abbildung
6 |
Die hier vorgestellten Ergebnisse verdeutlichen, dass die Gesetzgebung der EU für den Bereich der Kosmetika, bei der der EU Richtlinie 86/609/EWG zum Schutz der Versuchstiere eine besonders hohe Priorität eingeräumt wird, nicht zu einem Stillstand von Forschung und Neuentwicklung geführt, wie häufig behauptet wird, sondern die Kosmetikindustrie in Europa nimmt auch wissenschaftlich auf dem Gebiet der toxikologischen Sicherheitsprüfungen beim Vergleich mit Japan und den USA die führende Position ein. Das EU Tierschutzrecht hat daher auf dem Kosmetiksektor zur Marktführerschaft auf dem Weltmarkt geführt. Die 7. Änderung der Kosmetikrichtlinie der EU ist ein wichtiger Meilenstein zur Verstärkung der Position der europäischen Kosmetikindustrie auf dem Weltmarkt. Sie ist außerdem an der Realität konzipiert und berücksichtigt primär die Bedürfnisse der Verbraucher ohne den wissenschaftlichen Fortschritt und den Tierschutz zu vernachlässigen. Das Beispiel der Kosmetikindustrie macht deutlich, dass innovative wirtschaftliche Entwicklungen verbunden mit einer führenden Position auf dem Weltmarkt und zeitgemäßer Tierschutz sich nicht ausschließen, sondern dass sie gegenseitig ergänzen.
|
Abbildung
7
Für sicherheitstoxikologische Prüfungen von Kosmetika müssen Versuchstiere heute nicht mehr leiden. |
Literatur
EU Kommission (1976) EU Richtlinie 76/768/EEC zur Angleichung der gesetzlichen Grundlagen für kosmetische Produkte in den Mitgliedsstaaten. Brüssel, Belgien: EU DG Umwelt.
EU Kommission (1986) EU Richtlinie 86/609/EEC zu Schutz von Versuchstieren. Brüssel, Belgien: EU DG Umwelt.
EU Kommission (1983) EU Richtlinie 83/467EEC zur fünften technischen Anpassung der EU Richtlinie 67/548/EEC an die Gesetzgebung für die Klassifizierung, Verpackung und Kennzeichnung von Gefahrstoffen. Brüssel, Belgien: EU DG Umwelt.
EU Kommission (2000a) EU Richtlinie 2000/33/EU für die 21st Änderung von Anhang V der EU Richtinie 67/548/EEC zur Klassifizierung, Verpackung und Kennzeichnung von Gefahrstoffen: Test Methode B-40 "Hautätzung - in vitro Methode”. O. J. der EU Kommission vom 8. Juni 2000, L136, 85-97.
EU Kommission (2000b) EU Richtlinie 2000/33/EU für die 21st Änderung von Anhang V der EU Richtinie 67/548/EEC zur Klassifizierung, Verpackung und Kennzeichnung von Gefahrstoffen: Test Methode B-41 "Phototoxizität – in vitro 3T3 NRU Phototoxizitätstest ”. O. J. der EU Kommission vom 8. Juni 2000, L136, 85-97.
EU Kommission (2001).
Weissbuch für eine neue Chemikalienpolitik. Brüssel, Belgien im Internet:
http://europa.eu.int/comm/environment/chemicals/0188_de.pdf
EU Kommission (2003) EU Richtlinie 2003/15/EG zur Änderung der Richtlinie 76/768/EWG des rates zur Angleichung des rechtsvorschriften der Mitgliedsstaaten über kosmetische Mittel. O. J. der EU Kommission vom 11. März 2003, L66, 26-35
OECD (Organisation for Economic Co-operation and Development) (1982) OECD Guidelines for Testing of Chemicals. Paris, Frankreich: OECD Publikation Office.
OECD (1996) Final Report of the OECD Workshop on Harmonization of Validation and Acceptance Criteria for Alternative Toxicological Tests Methods. Paris, Frankreich: OECD Publication Office.
OECD (2002a) OECD guidelines for the testing of chemicals: Test Guideline 431 "In vitro skin corrosion: human skin model ". Paris, Frankreich, OECD Publication Office.
OECD (2002b) OECD guidelines for the testing of chemicals: Test Guideline 429 "Skin sensitisation: Local Lymph Node Assay. Paris, Frankreich, OECD Publication Office
OECD (2002c) OECD guidelines for the testing of chemicals: Test Guideline 428 "Skin absorption: in vitro method ". Paris, Frankreich, OECD Publication Office.
OECD (2002d) OECD guidelines for the testing of chemicals: Test Guideline 432 "In vitro 3T3 NRU phototoxicxity test". Paris, Frankreich, OECD Publication Office.
Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch G., de Silva, O., Holzhütter, H.G., Clothier, R., Desolle, P., Gerberick, G.F., Liebsch, M., Lovell, W.W., Maurer, T., Pfannenbecker, U., Potthast, J.M., Csato, M., Sladowski, D., Steiling, W. und Brantom, P.: The international EU/COLIPA in vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU Phototoxicity test. Toxic. in Vitro 12, 305-327, 1998a
Spielmann, H., Balls, M. Dupuis, J., Pape, W.J.W., de Silva, O., Holzhütter, H.G., Gerberick, F., Liebsch, M., Lovell, W.W., Pfannenbecker, U. und Brantom, P.: A special study on the phototoxic potential of UV filter chemicals from Annex II of the REU Directive 76/86 in the 3T3 NRU in vitro phototoxicity test. ATLA 26, 979-708, 1998b
Weil, C.S. und Scala, R.A.: Study of intra- and interlaboratory variability in the results of rabbit eye and skin irrtiation tests. Toxicol. Appl. Pharmacol. 19, 276-360; 1971
Autor
Professor Dr. med. Horst Spielmann

Zentralstelle zur Erfassung und Bewertung von Ersatz- und Ergänzungsmethoden zum Tierversuch (ZEBET) im Bundesinstitut für Risikobewertung (BfR) in Berlin
Korrespondenzadresse:
Dr. med. Horst Spielmann
Direktor und Professor
Leiter ZEBET im BfR
Diedersdorfer Weg 1
12277 BERLIN
Tel: 01888-412-2270
Fax: 01888-412-2958
E-mail: spielmann.zebet@bfr.bund.de
nach oben