GD — Gesellschaft für Dermopharmazie e.V.
| Home |
| Ausgabe: 1/2016 |
| 1/2015 |
| 1/2014 |
| 1/2013 |
| 1/2012 |
| 2/2011 |
| 1/2011 |
| 1/2010 |
| 1/2009 |
| 1/2008 |
| 2/2007 |
| 1/2007 |
| 2/2006 |
| 1/2006 |
| 2/2005 |
| 1/2005 |
| 2/2004 |
| 1/2004 |
| 2/2003 |
| 1/2003 |
| 2/2002 |
| 1/2002 |
| 4/2001 |
| 3/2001 |
| 2/2001 |
| 1/2001 |
| 1/2000 |
| Weitere Links: |
| Gesellschaft für Dermopharmazie |
 |
|
|
Autorenbeitrag
Th. Förster, C. Jassoy, D. Petersohn, K. Schlotmann und M. Waldmann-Laue
Systematische Bewertung neuer Wirkstoffe und Kosmetika
Vortrag anlässlich der 4. Jahrestagung der Gesellschaft für Dermopharmazie in Freiburg am 24. Mai 2000
Stufenförmige Testhierarchie
In
den letzten Jahren haben die biologischen und medizinischen Wissenschaften
große Fortschritte gemacht, über die mittlerweile fast wöchentlich in der
Presse berichte wird. Einiger dieser neuen Methoden werden auch für die
Kosmetikforschung von großer Bedeutung werden oder haben bereits Einzug
in einzelne Forschungsabteilungen der Kosmetikindustrie gefunden.
Zu diesen epochalen Errungenschaften zählen sicherlich Hautmodelle, und hier vor allem sogenannte "in-vitro"-Ganzhautmodelle. Ganzhautmodelle sind künstlich im Labor gezüchtete Hautstückchen, die analog zur menschlichen Haut aufgebaut sind und sich daher hervorragend für kosmetische Forschungszwecke eignen. Am prominenten Beispiel der Hautalterung soll gezeigt werden, wie Hautmodelle sinnvoll in eine Testhierarchie für kosmetische Wirkstoffe und Fertigprodukte eingebaut werden können.
Diese Testhierarchie durchläuft dabei drei Stufen. Am Anfang steht das sogenannte Substanz-Screening mit schnell durchzuführenden Tests an einfachen Hautzellkulturen. In diesem Testraster werden aus einer Vielzahl potentieller Wirkstoffe die mit zu geringer Wirksamkeit ausgesondert. In Stufe zwei der Testhierarchie kommen die neuen in-vitro-Hautmodelle zum Einsatz, um unter realistischen Anwendungsbedingungen die kosmetische Wirksamkeit zu untersuchen. In der dritten Stufe erfolgt schließlich die dermatologische Prüfung im Verbraucherpanel.
Chronologische und
umweltbedingte Hautalterung
Gealterte
Haut ist auf den ersten Blick durch das Auftreten von Falten, Schlaffheit
und Altersflecken zu erkennen. Im histologischen Schnitt erkennt man auch
einige Ursachen für diese Alterszeichen (Abbildung 1).
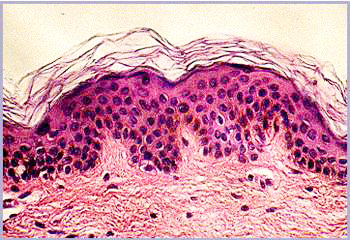
Abbildung
1a: Mkroskopischer Schnitt durch die Haut einer 21-Jährigen
Abbildung 1
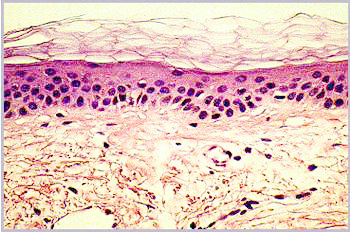
Abbildung
1b: Mikroskopischer Schnitt durch die Haut einer 66-Jährigen
Mikroskopische Schnitte durch die Haut von einer 21-Jährigen (a) und einer
66-Jährigen (b)
In junger Haut ist der untere Teil der Haut, die Dermis sehr regelmäßig aufgebaut. Diese klare Struktur ist im Alter gestört: Die Dermis enthält unregelmäßige Strukturen und Fehlstellen und erscheint weniger kompakt. Die nächsthöhere Schicht, die Epidermis, ist im Alter etwas dünner als in junger Haut. Viel auffälliger als diese geringe Änderung der Epidermisdicke ist aber das Verschwinden der Krümmungen der epidermalen-dermalen Grenzfläche. In gealterter Haut ist diese Grenzfläche flach, was zu einer Schwächung der Kohäsion zwischen Dermis und Epidermis führt. In der obersten Schicht schließlich, dem Stratum Corneum, sind im Mikroskop kaum Unterschiede festzustellen.
Wesentliche Veränderungen betreffen also die tieferen Hautschichten und hier vor allem die Dermis. Die biologische Ursache ist unter anderem in dem stark veränderten Collagenstoffwechsel zu finden. Die Collagene sind mengenmäßig mit ca. 60% der Trockenmasse der Hauptbestandteil der Haut (1). Untersucht man als Maß für die Syntheseaktivität die m-RNA der Fibroblasten einer jungen Alterskohorte mit der einer alten, so stellt man für zum Beispiel Procollagen Typ I eine Abnahme der Syntheseaktivität von ca. 60 % fest (2). Darüberhinaus steigt die Syntheserate für Collagenasen an (2). Es wird im Alter also nicht nur weniger Collagen hergestellt, sondern dieses wenige Collagen auch stärker abgebaut. Und beide Effekte führen zusammen dazu, dass der Collagengehalt im Schnitt um 1 % pro Lebensjahr abnimmt (3).
Wirkstoff-Screening mit
Fibroblasten-Kulturen
Fibroblasten
können aus der Dermis entnommen werden und als einfaches Zellsystem in sogenannter
Monolayer-Kultur weiter gezüchtet werden. Diese einfachen Fibroblasten-Kulturen
eignen sich einerseits zur Untersuchung von Schadeinflüssen auf die Fibroblasten
und andererseits als einfaches Testsystem zum Durchmustern ("Screening")
verschiedener Kosmetikwirkstoffe hinsichtlich ihrer stoffwechselbeeinflussenden
Wirksamkeit.
Die Fibroblasten in der
Dermis sind verantwortlich für die Collagenproduktion. Nach Aktivierung
des entsprechendne Genabschnitts im Zellkern und Transcription der Information
auf die m-RNA werden in den Ribosomen pro-a-Ketten hergestellt, die dann
im Cytoplasma durch Prolylhydroxylase enzymatisch zu Procollagen umgeformt
werden. Procollagen wird aus dem Fibroblasten ausgeschleußt und extrazellulär
wiederum enzymatisch zu Tropocollagenfasern

Abbildung 2a: Wirkung verschiedener Peptidextrakte auf die Zellanzahl
einer Fibroblastenkultur
Abbildung
2

Abbildung 2b: Wirkung verschiedener Peptidextrakte auf die Aktivierung
der Proteinsynthese einer Fibroblastenkultur
Wirkung verschiedener Peptidextrakte auf Fibroblasten-Stoffwechsel A: Einfluss
auf die Zellanzahl. B: Einfluss auf die Proteinsynthese (nach C. Augustin
et al., 1997)
verändert,
die sich schließlich zu den unlöslichen Collagenfasern in der extrazellulären
Matrix aneinanderlagern. Dieser komplexe Prozess kann auf verschiedenen
Ebenen durch Wirkstoffe beeinflusst werden. Bekannt
ist die Wirkung von Vitamin C auf die Prolylhydroxylase: Ohne Vitamin C
kommt die Collagenproduktion zum Erliegen, was die Ursache für Skorbut ist.
Aber auch andere Wirkstoffe können die Collagensyntheserate beeinflussen.
An
2 und 4 Tage alten Fibroblasten-Kulturen wurden verschiedene Peptidextrakte
auf Förderung der Proliferation und der Proteinsynthese untersucht (Abbildung
2).
Aus einer Reihe verschiedener Weizen-, Milch- und Sojapeptide wurde ein besonders vielversprechendes Sojapeptid 2 identifiziert, das eine 20%ige Aktivierung der Proteinsynthese zeigte (4).
Fibroblasten-Kulturen eignen sich nicht nur zum Studium der Collagensynthese sondern auch zur Untersuchung bestimmter Photoalterungsprozesse. Seit längerem ist bekannt, dass vor allem exzessives Sonnenbaden die Haut altern lässt (5,6). UV-Licht, das auf einen Fibroblasten in der Haut trifft, veranlasst diesen, collagenabbauende Enzyme, sogenannte Collagenasen oder Metallomatrixproteasen (MMP's) zu produzieren. Diese schädlichen Enzyme zerschneiden das Collagen, den Hauptbestandteil des Hautbindegewebes, und führen damit zur frühzeitigen Entstehung von Falten (5,6). Die Reduktion der MMP-1-Synthese nach Sonnenexposition der Haut ist daher ein Hauptziel bei der Entwicklung von Anti-aging-Produkten. Ein idealer Anti-age-Wirkstoff inhibiert bereits in geringer Konzentration die Expression der Collagenase MMP-1. Die Produktion der mRNA ist im Verlauf der MMP-1-Synthese der erste und damit wichtigste Schritt. Wirkstoffe, die einen Effekt auf die mRNA-Produktion zeigen, haben somit automatisch auch einen Effekt auf die Proteinmenge und die Enzymaktivität von MMP-1. Die Quantifizierung der MMP-1 Synthese in Sonnenlicht-bestrahlten Hautfibroblasten erfolgte durch die Bestimmung der synthetisierten Menge der MMP-1-mRNA im Northern-Blot (5).
Die Bestrahlung von Fibroblasten mit simuliertem Sonnenlicht (UVA-Dosis
von 10 J/cm2) führte erwartungsgemäß zu einer starken Induktion der MMP-1
mRNA-Synthese. Retinyl-Palmitat und Antioxidantien wie z.B. Propyl-Gallat
reduzieren die sonnenlichtinduzierte Expression von MMP-1 sehr effektiv
um rund 80 % bzw. 50 bis 75 % und wirken so der Lichtalterung der Haut
entgegen.

Abbildung 3a: Wirkung von Retinyl-Palmitat
Abbildung
3: Schutzwirkung von Retinyl-Palmitat (a) und Propyl-Gallat (b) auf
die sonnenlichtinduzierte Collagenaseexpression in Fibroblasten
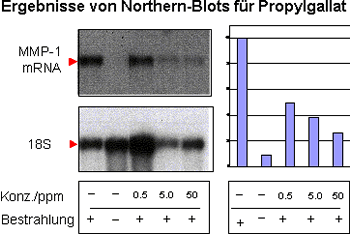
Abbildung 3a: Wirkung von Propyl-Gallat
Neue Untersuchungsmöglichkeiten
mit in-vitro-Ganzhautmodellen
Einfache
Fibroblasten-Kulturen erlauben ein rasches und kostengünstiges Screening
von Wirkstoffen auf einige grundlegende Wirksamkeiten. Die Ergebnisse, die
mit diesem einfachen Zellmodell erhalten werden, sind aber aus mehrern Gründen
nicht ohne weiteres auf die reale in-vivo-Situation zu übertragen. Einfache
Hautzellkulturen haben keine Hautbarriere (Stratum Corneum), so dass die
Wirkstoffe aus dem Kulturmedium angeboten werden. Die Konzentrationsverhältnisse
sind daher völlig anders und nicht auf reale Anwendungssituationen zu übertragen.
Weiterhin können nur wasserlösliche oder wasserlöslich gemachte Stoffe untersucht
werden, aber keine komplexen Cremeformulierungen. Und schließlich kann man
immer nur einen Hautzelltyp in diesem einfachen Modell untersuchen, so dass
die Wechselwirkungen zwischen Stratum Corneum, Epidermis und Dermis mit
den entsprechenden Hautzelltypen unberücksichtigt bleiben müssen.
Die in-vitro-Hautmodelle eröffnen neue Wege, all dies Unzulänglichkeiten
zu vermeiden. Durch sukzessives Züchten einer Dermis aus Fibroblasten
und einer Epidermis mit Stratum Corneum aus Keratinocyten entsteht innerhalb
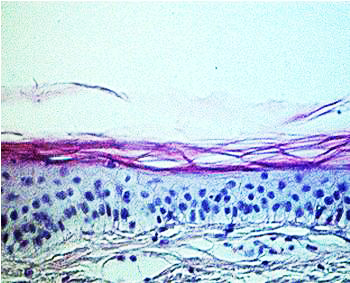
von 5 Wochen ein Ganzhautmodell (Abbildung 4), das alle wesentlichen Schichten
der Haut enthält (7) (Abbildung 5).

Abbildung
4: Kultivierung des Ganzhautmodells
Nach der Kultivierung
lebt das Ganzhautmodell mindestens 4 Wochen nahezu unverändert weiter. In
dieser Zeit können Alterungsexperimente wie zum Beispiel UV-Bestrahlung
oder Einwirkung von Ozon durchgeführt werden oder aber auch topische Behandlungen
zum Schutz oder zur Pflege der Haut. Der große Vorteil ist, dass diese Hautmodelle
ein Stratum Corneum wie normale menschliche Haut enthalten. Die Wirkstoffe
können daher unter realistischen Bedingungen in einer Creme- oder Gelgrundlage
aufgetragen werden. Die Wirkstoffe dringen durch das Stratum Corneum in
die Haut ein und entfalten dort ihre Wirksamkeit.
Für das im Fibroblastenexperiment ausgewählte Sojapeptid 2, ein Cytokin
aus der Sojapflanze, konnte nach 2-wöchiger topischer Anwendung aus einer
10%-igen Gelformulierung eine Steigerung der Collagensynthese um 37 % gezeigt
werden (8). Zusätzlich stimuliert dieses Cytokin auch die Hyaluronsäuresynthese
um 3 %, eine kleine aber dennoch signifikante Steigerung (8) (Abb. 6). Abgebautes
Collagen und fehlende Hyaluronsäure können so im Innern der gealterten Haut
ersetzt werden.
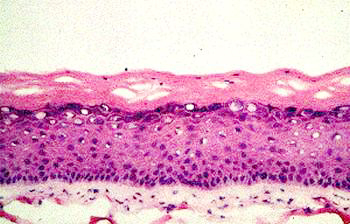
Abbildung 5 a
Abbildung
5 b
Abbildung
5: Histologischer Vergleich zwischen Ganzhautmodell (a) und
normaler menschlicher Haut
(b)
Der stimulierende Effekt
des Cytokins auf Hautzellen ist auch in-vivo nachweisbar. In einer klinischen
Studie benutzten 10 Freiwillige eine Creme mit 2 % des Cytokins im Halbseitenvergleich
mit der Plazebocreme im Augenwinkelbereich. Nach 2 Wochen täglicher Behandlung
wurden im Rahmen einer kosmetischen Operation Biopsien genommen und biochemisch
auf Collagen- und Glucosaminoglucan (GAG)-Gehalt untersucht. Nach zwei Wochen
Behandlung mit der Cytokin-haltigen Creme nahm der Collagengehalt in der
Haut um 29 % und der GAG-Gehalt um 20 % zu (8). Die in-vitro-Ergebnisse
konnten also eindrucksvoll bestätigt werden.
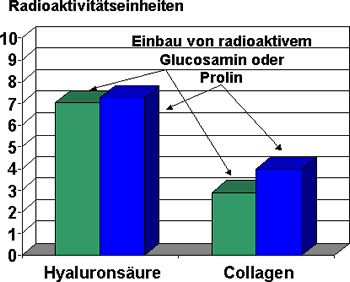
Abbildung
6: Stimulierung der Collagen- und Hyaluronsäuresynthese durch
Cytokin im Ganzhautmodell
Faltenreduktion durch Cytokin-Creme
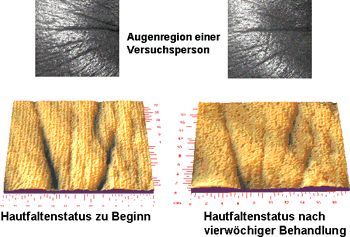
Nach den ermutigenden biochemischen Ergebnissen zur Collagen- und GAG-Stimulierung durch die Cytokin-Creme stellt sich - insbesondere aus Sicht des Verbrauchers - die entscheidende Frage, ob diese biologische Wirksamkeit auch zu einer Faltenreduktion führt. In einer kontrollierten Gebrauchsstudie benutzten 30 Probanden die Cytokin-Creme über 4 Wochen. Zu Beginn der Studie und am Ende wurde mittels FOITS (Fast Optical In-vivo Topography of the Skin) der Faltenstatus quantitativ bestimmt. Die Faltentiefe (Rauhigkeitstiefe Rz) nahm im Mittel um 16 % ab. Die einzelnen topographischen Aufnahmen zeigen deutlich die Abflachung der tiefen Falten im kritischen Augenwinkelbereich (Abb. 7).
Die Faltenglättung nach Cremebehandlung ist auch visuell deutlich zu erkennen und führt in der abschließenden Befragung der Probandinnen zu sehr guten Noten hinsichtlich Hautglätte (1,9), Hautstruktur (2,2), Hautgeschmeidigkeit (1,9) und Hautstraffheit (2,4).
An diesem Beispiel der Entwicklung einer Antiage-Creme mit dem Pflanzenwirkstoff Cytokin ist deutlich zu erkennen, wie die neu in der kosmetischen Forschung etablierten Ganzhautmodelle helfen, aussichtsreiche Wirkstoffe genauer zu charakterisieren. Insbesondere der Vergleich der in-vitro-Ergebnisse mit in-vivo-Daten zeigt, wie gut die Hautmodelle bereits die natürliche Situation nachahmen. In Zukunft werden uns Hautmodelle sicherlich noch viele biochemische Einsichten über die Wirkungsweise neuer aber auch bekannter Wirkstoffe liefern.
|
|
Literatur
1. C. R. Lovell, K. A. Smolenski, V. C. Duance, N. D. Light, S. Young, M. Dyson, Type I and III Collagen Content and Fibre Distribution in Normal Human Skin during Ageing, Brit. J. Dermatol. 117 (1987) 419-428
2. J. Varani, J. R. L. Warner, M. Gharaee-Kermani, S. H. Phan, S. Kang, J. Chung, Z. Wang, S. C. Datta, G. J. Fisher, J. J. Voorhees, Vitamin A antagonizes decreased cell growth and elevated collagen-degrading matrix metalloproteinases and stimulates colllagen accumulation in naturally aged human skin, J. Invest. Dermatol. 114 (2000) 480-486
3. S. Shuster, M. M. Black, E. McVitie, The influence of age and sex on skin thickness, skin collagen and density, Brit. J. Dermatology 93 (1975), 639-643
4. C. Augustin, V. Frei, E. Perrier, A. Huc, O. Damour, An in vitro selection of new cosmetic active compounds: From screening tests on monolayered fibroblast culture to efficiency study on 3-D dermal equivalent, J. Appl. Cosmetol. 15 (1997), 1-11
5. K. Scharffetter, M. Wlaschek, A. Hogg, K. Bolsen, A. Schothorst, G. Goerz, T. Krieg, G. Plewig, UVA irradiation induces collagenase in human dermal fibroblasts in vitro and in vivo, Arch. Dermatol. Res. 283 (1991), 506-511
6. G. J. Fisher, S. C. Datta, H. S. Talwar, Z. Wang, J. Varani, S. Kang, J. J. Voorhees, Nature 379 (1996) 335-339
7. C. Augustin, C. Collombel, O. Damour, Use of in vitro dermal equivalent and skin equivalent kits for evaluating cutaneous toxicity of cosmetic products, In Vitro Toxicology 10 (1997), 23-31
8. V. Andre-Frei, E. Perrier, C. Augustin, O. Damour, P. Bordat, K. Schumann, T. Förster, M. Waldmann-Laue, A comparison of biological activities of a new soya biopeptide studied in an in vitro skin equivalent model and human volunteers, Int. J. Cosmet. Sci. 21 (1999), 299-311
nach oben